Löslichkeitsprodukt
Das Löslichkeitsprodukt
Das Löslichkeitsprodukt gibt ein Maß für die Löslichkeit eines Stoffes in einem Lösmittel (häufig Wasser). Das Löslichkeitsprodukt kann über das Massenwirkungsgesetz berechnet werden. Grundsätzlich kann das Massenwirkungsgesetz wir folgt definiert werden:
Für Edukte ist der stöchiometrische Koeffizient  kleiner als Null, für Produkte größer. Beim Lösen eines Salzes MX in Wasser kann folgende Reaktionsgleichung formuliert werden: kleiner als Null, für Produkte größer. Beim Lösen eines Salzes MX in Wasser kann folgende Reaktionsgleichung formuliert werden:
Wird auf eine solche Reaktion das Massenwirkungsgesetz angewandt, so ergibt sich:
Die Indizes aq und s sollen lediglich den Aggregatszustand des jeweiligen Teilchens verdeutlichen, im weiteren Verlauf wird jedoch darauf verzichtet. Die eckigen Klammern stehen hierbei für die Aktivität des jeweiligen Teilchens und darf nicht mit der Konzentration verwechselt werden, auch wenn diese oft zur Berechnung als Näherung verwendet wird. Da die Aktivität von Feststoffen definitionsgemäß gleich 1 ist folgt dann letzendlich die übliche Gleichung für das Löslichkeitsprodukt L eines Salzes vom TYP MX.
Übungsaufgabe 1
Wie viel Strontiumfluorid löst sich in 150 mL NaF-Lösung (c=0.2 mol/L)?
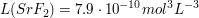
Das Gleichgewicht zwischen Feststoff und gelösten Ionen sieht wie folgt aus.
|